В термодинамике рассматривается перемещение частиц макроскопического тела относительно друг друга. При совершении работы меняется объем тела. Скорость самого тела остается равной нулю, но скорости
молекул тела меняются! Поэтому меняется и температура тела. Причина в том, что при столкновении с движущимся поршнем (сжатие газа) кинетическая энергия молекул изменяется — поршень отдает часть своей механической энергии. При столкновении с удаляющимся поршнем (расширение) скорости молекул уменьшаются, газ охлаждается. При совершении работы в термодинамике меняется состояние макроскопических тел: их объем и температура.
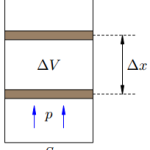
Газ, находящийся в сосуде под поршнем, действует на поршень с силой F’ = pS, где p — давление газа, S — площадь поршня. Если при этом поршень перемещается, то газ совершает работу. Предположим, что газ расширяется при постоянном давлении p. Тогда сила F’, с которой газ действует на поршень, также постоянна. Пусть поршень переместился на расстояние ∆x (рис.1). Работа газа равна: A’ = F’ ∆x = pS∆x = p∆V. – работа газа при изобарном расширении. Если V1 и V2 — начальный и конечный объём газа, то для работы газа имеем: A’ = p(V2 − V1). При расширении работа газа положительна. При сжатии — отрицательна. Таким образом: A’ = pΔV — работа газа. A= — pΔV — работа внешних сил.
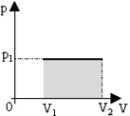
В изобарном процессе площадь под графиком в координатах p,V численно равна работе (рис. 2). Внешняя работа над системой равна работе системы, но с противоположным знаком А = — А’.
В изохорном процессе объем не меняется, следовательно, в изохорном процессе работа не совершается! A=0
Любое тело (газ, жидкость или твердое) обладает энергией, даже если тело не имеет скорости и находится на Земле. Эта энергия называется внутренней, обусловлена она хаотическим (тепловым) движением и взаимодействием частиц, из которых состоит тело. Внутренняя энергия состоит из кинетической и потенциальной энергии частиц поступательного и колебательного движений микрочастиц системы. Внутренняя энергия одноатомного идеального газа определяется по формуле: 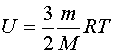 Внутренняя энергия тела может изменяться только в результате его взаимодействия с другими телами. Существует два способа изменения внутренней энергии: теплопередача и совершение механической работы (например, нагревание при трении или при сжатии, охлаждение при расширении).
Внутренняя энергия тела может изменяться только в результате его взаимодействия с другими телами. Существует два способа изменения внутренней энергии: теплопередача и совершение механической работы (например, нагревание при трении или при сжатии, охлаждение при расширении).
Теплопередача — это изменение внутренней энергии без совершения работы: энергия передается от более нагретых тел к менее нагретым телам. Теплопередача бывает трех видов: теплопроводность (непосредственный обмен энергией между хаотически движущимися частицами взаимодействующих тел или частей одного и того же тела); конвекция (перенос энергии потоками жидкости или газа) и излучение (перенос энергии электромагнитными волнами). Мерой переданной энергии при теплопередаче является количество теплоты (Q).
Эти способы количественно объединены в закон сохранения энергии, который для тепловых процессов читается так: изменение внутренней энергии замкнутой системы равно сумме количества теплоты, переданной системе, и работы внешних сил, совершенной над системой. ![]() , где ΔU— изменение внутренней энергии, Q — количество теплоты, переданное системе, А — работа внешних сил. Если система сама совершает работу, то ее условно обозначают А’. Тогда закон сохранения энергии для тепловых процессов, который называется первым законом термодинамики, можно записать так:
, где ΔU— изменение внутренней энергии, Q — количество теплоты, переданное системе, А — работа внешних сил. Если система сама совершает работу, то ее условно обозначают А’. Тогда закон сохранения энергии для тепловых процессов, который называется первым законом термодинамики, можно записать так: ![]() ( количество теплоты, переданное системе, идет на совершение системой работы и изменение ее внутренней энергии).
( количество теплоты, переданное системе, идет на совершение системой работы и изменение ее внутренней энергии).
Рассмотрим применение первого закона термодинамики к изопроцессам, происходящим с идеальным газом.
В изотермическом процессе температура постоянная, следовательно, внутренняя энергия не меняется. Тогда уравнение I закона термодинамики примет вид: Q = А’, т. е. количество теплоты, переданное системе, идет на совершение работы при изотермическом расширении, именно поэтому температура не изменяется.
В изобарном процессе газ расширяется и количество теплоты, переданное газу, идет на увеличение его внутренней энергии и на совершение им работы: Q = ΔU +А’
При изохорном процессе газ не меняет своего объема, следовательно, работа им не совершается, т. е. А = 0. Уравнение I закона имеет вид Q = ΔU (переданное количество теплоты идет на увеличение внутренней энергии газа).
Адиабатным называют процесс, протекающий без теплообмена с окружающими телами. Пример теплоизолированного сосуда — термос. При адиабатном процессе Q = 0, следовательно, газ при расширении совершает работу за счет уменьшения его внутренней энергии, следовательно, газ охлаждается, А’= — ΔU. Если заставить газ совершить достаточно большую работу, то охладить его можно очень сильно. Именно на этом основаны методы сжижения газов. И наоборот, в процессе адиабатного сжатия будет А > 0, поэтому ∆U > 0: газ нагревается. Адиабатное нагревание воздуха используется в дизельных двигателях для воспламенения топлива
Практически все реальные процессы происходят с теплообменом: адиабатические процессы — это редкое исключение.
Наглядные примеры адиабатных процессов:
- В закрытом пробкой с продетым шлангом насоса сосуде находится капельки воды. После нагнетания в сосуд определенно количества воздуха, пробка быстро вылетает и в сосуде наблюдается туман (рис.).
- В закрытом подвижным поршнем цилиндре находится небольшое количество топлива. После быстрого нажатия на поршень топливо воспламеняется.