 Опыты Резерфорда по рассеянию альфа-частиц.Ядерная модель атома.
Опыты Резерфорда по рассеянию альфа-частиц.Ядерная модель атома.
Известно, что слово «атом» в переводе с греческого означает «неделимый». Английский физик Дж. Томсон разработал (в к. ХIХ в.) первую «модель атома», согласно которой атом — положительно заряженная сфера, внутри которой плавали электроны. Модель, предложенная Томсоном, нуждалась в экспериментальной проверке, т. к. явления радиоактивности, фотоэффекта нельзя было объяснить, применив модель атома Томсона. Поэтому в 1911 году Эрнест Резерфорд провел ряд опытов по исследованию состава и строения атомов. В этих опытах узкий пучок a -частиц, испускаемых радиоактивным веществом, направлялся на тонкую золотую фольгу. За ней помещался экран, способный светиться под ударами быстрых частиц. Было обнаружено, что большинство – a-частиц отклоняется от прямолинейного распространения после прохождения фольги, т. е. рассеивается, а некоторые a-частицы отбрасываются на 1800.
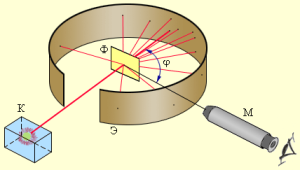
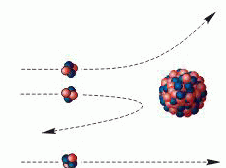
- Рассеяние a-частиц Резерфорд объяснил, что положительный заряд не распределен равномерно в шаре радиусом 10-10м, как предполагали ранее, а сосредоточен в центральной части атома — атомном ядре. На основе своих опытов Резерфорд предложил планетарную модель атома. Электроны в этой модели обращаются на больших расстояниях вокруг ядра, подобно тому, как планеты обращаются вокруг Солнца. Однако такой атом согласно законам классической физики не может быть устойчивым. Электроны должны излучать, теряя энергию, и падать на ядро. В действительности все атомы устойчивы. Разрешить противоречия планетарной ядерной модели строения атома первым попытался датский физик Нильc Бор.
Основу теории Бора составляют два постулата. - Первый постулат (постулат стационарных состояний): В атоме существуют стационарные квантовые состояния, не изменяющиеся с течением времени без внешнего воздействия на атом.
В этих состояниях атом не излучает электромагнитных волн, хотя и движется с ускорением. Каждому стационарному состоянию атома соответствует определенная энергия атома. Стационарным состояниям соответствуют стационарные орбиты, по которым движутся электроны. - Второй постулат (правило частот): При переходе атома из одного
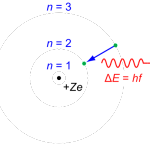 стационарного состояния в другое излучается или поглощается 1 фотон. Энергия излученного или поглощенного фотона равна разности энергий стационарных состояний: hνkn = Ek — En . (1) При излучении фотона k > n, при поглощении k < n. Из формулы можно выразить частоту излучения так: ν = (En – Ek) /h.
стационарного состояния в другое излучается или поглощается 1 фотон. Энергия излученного или поглощенного фотона равна разности энергий стационарных состояний: hνkn = Ek — En . (1) При излучении фотона k > n, при поглощении k < n. Из формулы можно выразить частоту излучения так: ν = (En – Ek) /h.
Лазеры
На основе квантовой теории излучения были построены квантовые генераторы радиоволн и квантовые генераторы видимого света – лазеры. Лазеры создают когерентное излучение очень большой мощности. Излучение лазеров очень широко применяется в различных областях науки и техники, например, для связи в космосе, для записи и хранения информации (лазерные диски) и сварки, в медицине.
Испускание и поглощение света атомами
Согласно постулатам Бора электрон может находиться на нескольких определенных орбитах. Каждой орбите электрона соответствует определенная энергия. При переходе электрона с ближней на дальнюю орбиту атомная система поглощает квант энергии. При переходе с более удаленной орбиты электрона на ближнюю орбиту по отношению к ядру, атомная система излучает квант энергии.
Спектры
Теория Бора позволила объяснить существование линейчатых спектров.
Формула (1) даёт качественное представление о том, почему атомные спектры испускания и поглощения являются линейчатыми. В самом деле, атом может излучать волны лишь тех частот, которые соответствуют разностям значений энергии E1, E2, . . . , En, . . Вот поэтому спектр излучения атомов состоит из отдельно расположенных резких ярких линий. Вместе с тем, атом может поглотить не любой фотон, а только тот, энергия hν которого в точности равна разности En − Ek каких-то двух разрешённых значений энергии En и Ek. Переходя в состояние с более высокой энергией En, атомы поглощают ровно те самые фотоны, которые способны излучить при обратном переходе в исходное состояние Ek. Попросту говоря, атомы забирают из непрерывного спектра те линии, которые сами же и излучают; вот почему тёмные линии спектра поглощения холодного атомарного газа находятся как раз в тех местах, где расположены яркие линии спектра испускания этого же газа в нагретом состоянии.


