Атомистическая теория — современная теория строения вещества — зародилась еще в Древней Греции. Основное направление мысли древнегреческих философов основывалось на представлении о непрерывности материи (взгляд Аристотеля). Однако некоторые древнегреческие философы, особенно Демокрит, не соглашались с такой точкой зрения и считали, что материя состоит из мельчайших неделимых частиц. Демокрит называл их атомами, что значит “неделимые”. То, что вещество состоит из  мельчайших частиц – молекул и атомов экспериментально доказывают броуновское движение и явление диффузия.
мельчайших частиц – молекул и атомов экспериментально доказывают броуновское движение и явление диффузия.
Идеальный газ — это физическая модель реального газа, взаимодействие, между молекулами которого пренебрежимо мало. Модель введена для математического описания поведения газов. Реальные разреженные газы (верхние слои атмосферы) ведут себя как идеальный газ.
Свойства идеального газа:
- молекулы — это упругие шары;
- расстояние между молекулами намного больше размеров молекул- диаметра (r>d);
- силы отталкивания возникают только при их соударении;
- движение молекул подчиняется законам Ньютона;
- давление газа на стенки сосуда оказывается за счет ударов молекул газа.
Давление газа на стенки сосуда пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
![]() или
или ![]() — выражения основного уравнения МКТ, где р — давление газа на стенки сосуда (Па); n — концентрация молекул, т.е. число молекул в единице объема n=N/V, ( 1/м3); m0 — масса одной молекулы (кг);
— выражения основного уравнения МКТ, где р — давление газа на стенки сосуда (Па); n — концентрация молекул, т.е. число молекул в единице объема n=N/V, ( 1/м3); m0 — масса одной молекулы (кг); ![]() — средняя квадратичная скорость движения газовых молекул (м/с); ρ — плотность газа (кг/м3);
— средняя квадратичная скорость движения газовых молекул (м/с); ρ — плотность газа (кг/м3); ![]() — средняя кинетическая энергия молекул (Дж).
— средняя кинетическая энергия молекул (Дж).
Основное уравнение МКТ идеального газа связывает микропараметры частиц ( массу молекулы, средний квадрат скорости молекул) с макропараметрами газа (р — давление, V — объем, Т — температура).
Температура характеризует степень нагретости тела, тепловое равновесие, указывает направление теплообмена. Измеряют температуру термометром. При измерении температуры используется зависимость изменения какого-либо макроскопического параметра (объема, давления, электрического сопротивления и т.д.) вещества от температуры. В жидкостных термометрах — это изменение объема жидкости. В процессе измерения температура тела и термометра приходят в состояние теплового равновесия.
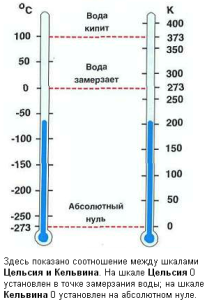 Абсолютная шкала температур введена англ. физиком У. Томсоном(Кельвином). Ее называют шкалой Кельвина или термодинамической температурной шкалой. В ней нет отрицательных температур. Абсолютная шкала температуры называется так, потому что мера нижнего предела температуры — абсолютный ноль, то есть наиболее низкая возможная температура, при которой молекулы вещества перестают двигаться. Единица абсолютной температуры в СИ: [T]=1K (Кельвин). Нулевая температура абсолютной шкалы – это абсолютный ноль 00К = −273.15 °C (точно). По величине 1К = 10С. Шкала температур Кельвина — это шкала, в которой начало отсчёта ведётся от абсолютного нуля.
Абсолютная шкала температур введена англ. физиком У. Томсоном(Кельвином). Ее называют шкалой Кельвина или термодинамической температурной шкалой. В ней нет отрицательных температур. Абсолютная шкала температуры называется так, потому что мера нижнего предела температуры — абсолютный ноль, то есть наиболее низкая возможная температура, при которой молекулы вещества перестают двигаться. Единица абсолютной температуры в СИ: [T]=1K (Кельвин). Нулевая температура абсолютной шкалы – это абсолютный ноль 00К = −273.15 °C (точно). По величине 1К = 10С. Шкала температур Кельвина — это шкала, в которой начало отсчёта ведётся от абсолютного нуля.
В формулах абсолютная температура обозначается буквой «Т», а температура по шкале Цельсия буквой «t». T = t+273(K).
После введения абсолютной температуры получаем выражение: 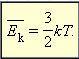 — средняя кинетическая энергия поступательного движения молекул, где
— средняя кинетическая энергия поступательного движения молекул, где ![]() — постоянная Больцмана, устанавливает связь между энергетическими и температурными единицами.
— постоянная Больцмана, устанавливает связь между энергетическими и температурными единицами.
Температура – мера средней кинетической энергии теплового движения частиц вещества.
Большое спасибо! Мне помогло. Много полезного!