 Давление газа возникает в результате столкновений молекул со стенками сосуда ( и на помещенное в газ тело ), в котором находится беспорядочно движущиеся молекулы газа. Чем чаше удары, тем они сильнее – тем выше давление. Если масса и объем газа неизменны, то его давление в закрытом сосуде всецело зависит от температуры. Давление зависит и от скорости поступательно движущихся газовых молекул. Единица измерения давления — паскаль p(Па). Измеряют давление газа манометром (жидкостным, металлическим и электрическим).
Давление газа возникает в результате столкновений молекул со стенками сосуда ( и на помещенное в газ тело ), в котором находится беспорядочно движущиеся молекулы газа. Чем чаше удары, тем они сильнее – тем выше давление. Если масса и объем газа неизменны, то его давление в закрытом сосуде всецело зависит от температуры. Давление зависит и от скорости поступательно движущихся газовых молекул. Единица измерения давления — паскаль p(Па). Измеряют давление газа манометром (жидкостным, металлическим и электрическим).
Идеальный газ – это модель реального газа. За идеальный газ принимают газ в сосуде, когда молекула, пролетая от стенки до стенки сосуда не испытывает столкновения с другими молекулами. Точнее, Идеальный газ – это газ, взаимодействие между молекулами которого пренебрежимо мало ⇒ Eк >> Eр .
Основное уравнение МКТ связывает макроскопические параметры (давление p, объём V, температура T, масса m) газовой системы с микроскопическими параметрами (масса молекулы , средняя скорость их движения): ![]()
, где n— концентрация, 1/м3; m — масса молекулы, кг; ![]() — средняя квадратичная скорость молекул, м/с.
— средняя квадратичная скорость молекул, м/с.
Уравнение состояния идеального газа — формула, устанавливающая зависимость между давлением, объёмом и абсолютной температурой идеального газа, характеризующее состояние данной системы газа. 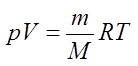 — уравнение Менделеева — Клапейрона (для произвольной массы газа). R = 8,31 Дж/моль·К — универсальная газовая постоянная. pV = RT – (для 1 моля).
— уравнение Менделеева — Клапейрона (для произвольной массы газа). R = 8,31 Дж/моль·К — универсальная газовая постоянная. pV = RT – (для 1 моля).
Часто необходимо исследовать ситуацию, когда меняется состояние газа при его неизменном количестве (m=const) и в отсутствие химических реакций (M=const). Это означает, что количество вещества ν=const. Тогда:
Для постоянной массы идеального газа отношение произведения давления на объем к абсолютной температуре в данном состоянии есть величина постоянная: 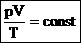 — уравнение Клапейрона.
— уравнение Клапейрона.
Термодинамический процесс (или просто процесс) — это изменение состояния газа с течением времени. В ходе термодинамического процесса меняются значения макроскопических параметров — давления, объёма и температуры. Особый интерес представляют изопроцессы — термодинамические процессы, в которых значение одного из макроскопических параметров остаётся неизменным. Поочерёдно фиксируя каждый из трёх параметров, мы получим три вида изопроцессов.
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака. Эти законы называют законами для изопроцессов:
Изопроцессы – это процессы, которые совершаются при одинаковом параметре или Т-температуре, или V-объеме, или р-давлении.
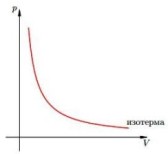 Изотермический процесс —
Изотермический процесс —![]() — закон Бойля — Мариотта (при постоянной температуре и данной массы газа произведение давления на объем есть величина постоянная)
— закон Бойля — Мариотта (при постоянной температуре и данной массы газа произведение давления на объем есть величина постоянная)
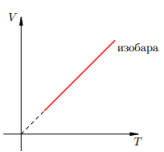 Изобарный процесс —
Изобарный процесс — 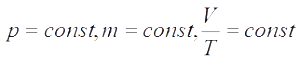 — закон Гей-Люссака (при постоянном давлении для данной массы газа отношение объема к температуре есть величина постоянная)
— закон Гей-Люссака (при постоянном давлении для данной массы газа отношение объема к температуре есть величина постоянная)
Изохорный п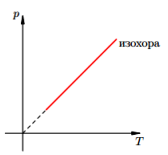 роцесс —
роцесс —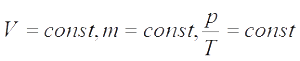 — закон Шарля (при постоянном объеме для данной массы газа отношение давления к температуре есть величина постоянная.
— закон Шарля (при постоянном объеме для данной массы газа отношение давления к температуре есть величина постоянная.
Вывели газовые законы из уравнения Менделеева — Клапейрона. Но исторически всё было наоборот: газовые законы были установлены экспериментально, и намного раньше. Уравнение состояния появилось впоследствии как их обобщение.
хороший билет, мне очень понравился, прям кровь будоражит. Спасибо за краткий ответ к билету.